 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

胆管癌五款靶向治疗药物新进展,延长生存期三倍以上
【本文为疾病百科知识,仅供阅读】 2021-07-27 作者:厚朴方舟
胆管癌是一种常见的恶性肿瘤,由于胆管癌早期症状不明显,且侵袭性较强,预后相对较差,多数患者确诊时已经无法手术(仅有35%可采用手术切除),5年生存率约为5%~15%[3]。且现有的化疗方案不佳,急需新的治疗方案。随着基础研究的深入,胆管癌相关驱动基因逐渐被发现,相应的靶向新药也不断涌现,显现出良好的效果。现如今,已有5款胆管癌靶向药物显现出良好的效果,可将晚期胆管癌患者的生存期提高三倍以上。
相关阅读:厚朴方舟案例丨日本专家联合会诊肝门胆管癌手术,勇攀普外科手术的珠穆朗玛峰
▲图源:europeanpharmaceuticalreview
一、FGFR靶点:三款靶向药物显著延长生存期
FGFR是一类典型的受体酪氨酸激酶,其家族包括FGFR1、FGFR2、FGFR3和FGFR4四种受体。在人体内,FGF/FGFR通路的异常激活可以促进细胞增殖、上皮间质转化和血管生成,并推动肿瘤细胞的侵袭、转移和对治疗的耐受。FGFR2是FGFR突变中常见的一种亚型,FGFR2是胆管癌重要的治疗靶点之一,在9%~14%的胆管癌患者的肿瘤中发现了FGFR2融合。
1.头款胆管癌靶向药Pemazyre延长生存期近三倍
2020年4月,Pemazyre率先获得美国FDA批准,用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌患者;2021年3月日本厚生劳动省(MHLW)批准Pemazyre用于治疗胆管癌,目前日本各大医院已可采用Pemazyre治疗胆管癌患者。
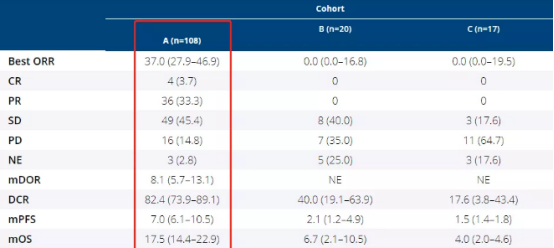
2021年美国临床肿瘤学会(ASCO)中,相关研究人员公布了Pemazyre的临床试验FIGHT-202新生存期数据[2]。
▲图源:meetinglibrary
研究结果显示:存在FGFR2基因融合突变或重排突变的胆管癌患者,使用Pemazyre病灶缩小超过30%,中位无进展生存期(mPFS)为7个月;中位总生存期为17.5个月,与二线化疗的总生存期仅6个月相比,延长近三倍;缓解率为37%(二线化疗的缓解率不足10%)。
2.Futibatinib治疗胆管无进展、总生存期双延长
4月12日,美国癌症研究协会(AACR)2021年会公布了共价结合FGFR抑制剂futibatinib(TAS-120)2期FOENIX-CCA2研究的效果和安全性数据。此次研究评估了futibatinib治疗携带FGFR2基因重排(包括基因融合)、接受过至少一种治疗方法治疗失败的局部晚期或转移性肝内胆管癌(iCCA)患者的效果[3]。

▲图源:prnewswire
研究结果显示,futibatinib治疗的缓解率(ORR)为41.7%;中位缓解持续时间(DOR)为9.7个月,72%的患者缓解时间超过6个月,疾病控制率(DCR)为82.5%;中位无进展生存期(PFS)为9.0个月、中位总生存期(OS)为21.7个月,延长胆管癌生存期三倍以上,72%的患者在12个月时存活[6]。
3.Infigratinib治疗胆管癌的缓解率提高一倍以上
Infigratinib是一种选择性FGFR酪氨酸激酶抑制剂,于5月份获FDA加速批准用于已接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌患者[3]。今年6月,美国食品和药物管理局(FDA)已加速批准Truseltiq(infigratinib),用于治疗先前接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)患者。
▲图源:businesswire
Infigratinib的获批主要是基于一项单臂的II期临床研究数据,结果显示,接受Truseltiq治疗的患者中,缓解率(ORR)为23%,与二线化疗缓解率仅10%相比,提高一倍以上;中位缓解持续时间(DoR)5.0个月[4]。
二、IDH1靶点:Ivosidenib将死亡风险降低63%
异柠檬酸脱氢酶-1(IDH1)是一种代谢酶,正常情况下能够帮助分解营养物质,为细胞产生能量。当其发生突变时,IDH1导致代谢产物d-2-羟基戊二酸(2-HG)水平升高,阻断细胞正常分化,并促进细胞迅速增殖。IDH1突变发生在大约13%的胆管癌患者中。
Ivosidenib是一种IDH1突变靶向抑制剂,今年3月,相关研究人员已向FDA提交了一份关于ivosidenib(Tibsovo)的新药申请(NDA),申请该药成为先前接受治疗的IDH1突变型胆管癌患者的潜在治疗方案。

▲图源:FDA
此前,在美国临床肿瘤学会胃肠道癌症研讨会(ASCO-GU)上中披露了Ivosidenib治疗胆管癌效果的III期临床试验ClarIDHy的数据。结果显示,与对照组相比,Ivosidenib将疾病进展或死亡风险降低63%;显著延长生存期(Ivosidenib组总生存期为10.3个月,对照组为7.5个月)[5]。
三、NTRK靶点:Entrectinib的缓解率高达54.5%
神经营养原肌球蛋白受体激酶(NTRK)的作用是维持神经细胞的存活和正常功能。但若NTRK基因发生了融合突变,就会使细胞异常增殖,从而导致肿瘤的发生。NTRK融合包括NTRK1, NTRK2或者NTRK3基因融合,已被发现与多种肿瘤的发生发展有关,包括胆管癌。
Entrectinib是一款针对ROS1、ALK及NTRK融合的泛靶点药物,血脑屏障的通透作用良好。2019年8月,美国FDA批准Entrectinib(Rozlytrek)上市,治疗携带NTRK基因融合的成年和青少年癌症患者(包括胆管癌患者);早在2019年6月,Entrectinib已在日本成功上市。

▲图源:prnewswire
在Entrectinib治疗实体瘤的临床试验中共纳入来自10类实体瘤的患者,其中就包括了胆管癌患者。结果显示,Entrectinib治疗这部分实体瘤患者的缓解率达到了54.5%,其中超过25%的患者实现了临床完全缓解;中位缓解持续时间(DoR)为10.4个月[6]。
随着临床研究的深入开展,越来越多的靶点将会被发现,胆管癌患者的选择也将会越来越多,预后也会越来越好。如希望了解更多世界先进的胆管癌治疗方案,可以拨打热线400-086-8008联系我们。
参考文献:
[1]Krasinskas A M. Cholangiocarcinoma[J]. Surg Pathol Clin, 2018,11(2): 403-429.
[2]Pemigatinib for previously treated locally advanced/metastatic cholangiocarcinoma (CCA): Update of FIGHT-202.
https://meetinglibrary.asco.org/record/197197/abstract
[3]Taiho Oncology Announces Presentation of Phase 2 Data for Futibatinib (TAS-120) in Advanced Intrahepatic Cholangiocarcinoma at Virtual AACR Annual Meeting 2021
[4] BridgeBio Pharma’s Affiliate QED Therapeutics and Partner Helsinn Group Announce FDA Approval of TRUSELTIQTM (infigratinib) for Patients with Cholangiocarcinoma.
[5] FDA Receives New Drug Application for Ivosidenib in IDH1+ Cholangiocarcinoma
https://www.targetedonc.com/view/fda-receives-new-drug-application-for-ivosidenib-in-idh1-cholangiocarcinoma
[6] FDA approves third oncology drug that targets a key genetic driver of cancer, rather than a specific type of tumor
https://www.prnewswire.com/news-releases/fda-approves-third-oncology-drug-that-targets-a-key-genetic-driver-of-cancer-rather-than-a-specific-type-of-tumor-300902681.html
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:世界初次将循环死亡后捐献心脏移植应用于儿童,让心脏“起死回生” 下一篇:提高脑肿瘤预后,溶瘤病毒+神经干细胞、聚焦超声多项治疗突破血脑屏障
热门服务
推荐阅读
日本权威医学专家
日本医院排名
服务案例更多>
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号