 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

首页 > 疾病导医 > 癌症肿瘤类 > 胆管癌 > 2022整理丨胆管癌靶向免疫药物有哪些治疗效果如何
2022整理丨胆管癌靶向免疫药物有哪些治疗效果如何
【本文为疾病百科知识,仅供阅读】 2022-04-28 作者:厚朴方舟
胆管癌是一种侵袭性较强且预后较差的恶性肿瘤,化疗作为晚期胆管癌的主要治疗手段,效果不佳,且常常出现耐药,因此晚期胆管癌患者急需更有效的治疗手段。近年来,研究人员一直在探索针对胆管癌靶向和免疫治疗,目前已有多款药物显现出突出的效果。那么这些靶向免疫药物治疗胆管癌效果如何?
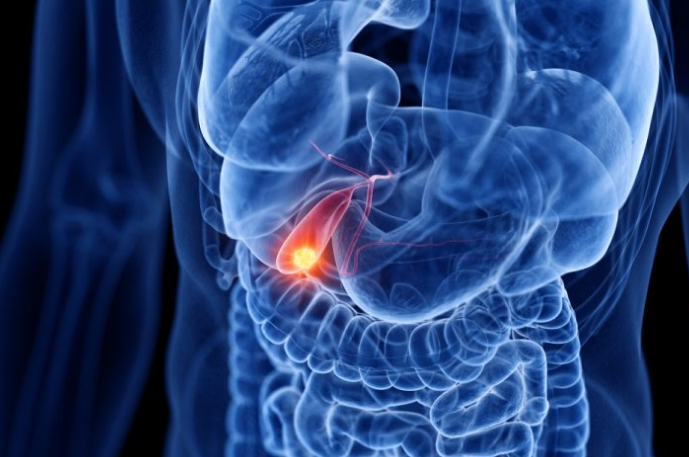
▲图源:europeanpharmaceuticalreview
一、胆管癌的靶向治疗
1、头款胆管癌靶向药物Pemazyre
2020 年 4 月,成纤维细胞生长因子受体(FGFR)抑制剂Pemazyre(培米替尼)获美国 FDA 批准上市,成为全球头款胆管癌靶向药物。临床研究结果显示,Pemazyre将胆管癌的中位无进展生存期(PFS)和总生存期(OS)成倍延长。
今年3月,Pemazyre(培米替尼)也被日本厚生劳动省(MHLW)批准,可应用于胆管癌的治疗[1]。
▲图源:prtimes.jp
2、Futibatinib延长胆管癌生存期三倍以上
今年3月,美国FDA已经接受Futibatinib的新药申请(NDA),用于治疗携带FGFR2基因重排(包括基因融合)的局部晚期或转移性胆管癌经治患者[2]。

▲图源:参考来源[2]
2期FOENIX-CCA2研究结果显示,futibatinib治疗携带FGFR2基因重排(包括基因融合)、接受过至少一种方案治疗失败的局部晚期或转移性胆管癌的缓解率(ORR)为41.7%;中位缓解持续时间(DOR)为9.7个月,72%的患者缓解时间超过6个月,疾病控制率(DCR)为82.5%;中位无进展生存期(PFS)为9.0个月、中位总生存期(OS)为21.7个月,延长胆管癌生存期三倍以上(二线化疗的总生存期仅6个月)[3]。
3、Truseltiq提高胆管癌缓解率一倍以上
2021年6月,美国食品和药物管理局(FDA)已加速批准Truseltiq(infigratinib),用于治疗先前接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)患者。
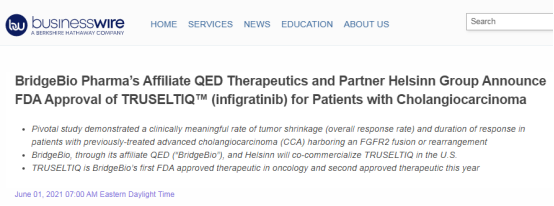
▲图源:参考来源[4]
Infigratinib的获批主要是基于一项单臂的II期临床研究数据,结果显示,接受Truseltiq治疗的患者中,缓解率(ORR)为23%,与二线化疗缓解率仅10%相比,提高一倍以上;中位缓解持续时间(DoR)5.0个月[4]。
4、Entrectinib治疗胆管癌缓解率达54.5%
Entrectinib是一款针对ROS1、ALK及NTRK融合的泛靶点药物,血脑屏障的通透作用良好。2019年8月,美国FDA批准Entrectinib(Rozlytrek)上市,治疗携带NTRK基因融合的成年和青少年癌症患者(包括胆管癌患者);早在2019年6月,Entrectinib已在日本成功上市。

▲图源:参考来源[6]
在Entrectinib治疗实体瘤的临床试验中共纳入来自10类实体瘤的患者,其中就包括了胆管癌患者。结果显示,Entrectinib治疗这部分实体瘤患者的缓解率达到了54.5%,其中超过25%的患者实现了临床完全缓解;中位缓解持续时间(DoR)为10.4个月[6]。
二、胆管癌免疫治疗
相比进展颇丰的胆管癌靶向治疗,胆管癌的免疫治疗目前仅有一款药物的效果显著优于传统方案。
1、初款效果显著的胆管癌一线免疫治疗
2021年11月,针对胆管癌一线免疫治疗的TOPAZ-1 3期试验结果公布,此次数据表明,抗PD-L1药物Imfinzi(英飞凡,通用名:durvalumab,度伐利尤单抗)联合化疗显著延长了胆管癌患者的总生存期(OS)、无进展生存期(PFS),显著提高缓解率(ORR)[5]。

▲图源:参考来源[5]
虽然胆管癌的恶性程度较高,但靶向治疗、免疫治疗等创新方案的出现为胆管癌患者提供了新的选择,也为患者带来了新的希望。相信随着临床研究的深入开展,将会有越来越多的创新方案获批于临床,让更多胆管癌患者受益。
厚朴方舟作为国内海外医疗服务机构的佼佼者,与世界胆管癌权威专家均有着深入的合作关系,可以为胆管癌患者提供远程会诊及一站式出国看病,确定优选诊治方案。如有需要或希望了解更多胆管癌治疗内容,可以直接在线咨询医学顾问或拨打热线400-086-8008联系我们。
参考来源:
[1] インサイト・コーポレーション、ペマジール®(ペミガチニブ)の国内製造販売承認取得を発表
[2] U.S. Food and Drug Administration (FDA) Accepts for Priority Review Taiho Oncology's New Drug Application for Futibatinib for Cholangiocarcinoma
[3] Taiho Oncology Announces Presentation of Phase 2 Data for Futibatinib (TAS-120) in Advanced Intrahepatic Cholangiocarcinoma at Virtual AACR Annual Meeting 2021
[4] BridgeBio Pharma’s Affiliate QED Therapeutics and Partner Helsinn Group Announce FDA Approval of TRUSELTIQTM (infigratinib) for Patients with Cholangiocarcinoma.
[5] Imfinzi plus chemotherapy significantly improved overall survival in 1st-line advanced biliary tract cancer in TOPAZ-1 Phase III trial at interim analysis
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:胆管癌靶向治疗新进展 胆管癌新靶向药Derazantinib疾病控制率达74% 下一篇:胆管癌首款免疫疗法获FDA批准 免疫治疗已成为胆管癌的一线选择
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号