 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

首页 > 疾病导医 > 呼吸系统疾病 > 肺纤维化 > 肺纤维化治疗:日本发现肺纤维化发展机制,有望开发肺纤维化新药
肺纤维化治疗:日本发现肺纤维化发展机制,有望开发肺纤维化新药
【本文为疾病百科知识,仅供阅读】 2020-04-16 作者:厚朴方舟
肺纤维化是一种无法逆转的疾病。分离的含核非典型单核细胞(SatMs)对于纤维化的发展至关重要。日前,日本一个科研团队发现了一种与纤维化相关的新型基因——RBM7,并通过研究阐明了RBM7引起的纤维化发展的部分机制。相关研究结果在线发表在美国权威科学期刊《Immunity》上。
图源:sciencedirect.com
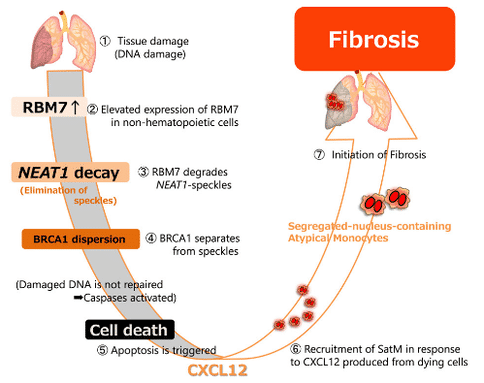
研究人员使用小鼠博来霉素肺纤维化模型进行实验,发现CXCL12是在纤维化阶段由肺分泌的趋化因子,在巨噬细胞Segregated nucleus containing atypical monocyte (SatM)迁移中起重要作用。肺纤维化时非免疫类细胞开始死亡,垂死的细胞表达CXCL12,做为纤维化起点的SatM会聚集到患部。基于此,研究人员认为对非免疫系统(围绕免疫系统的环境)的研究对于阐明纤维化的机制很重要,并且对非免疫细胞进行了全面的基因表达分析以发展纤维化。
研究人员发现当非免疫细胞中发生细胞死亡时,RBM7基因被特异性诱导。该分子分解非编码RNA NEAT1。结果,局部存在于NEAT1形成的核内结构体(NEAT1-speckle)中的BRCA1(修复DNA损伤的蛋白质)在核内的分布出现变化,进而诱导细胞死亡。该结果是世界上初次发现。
基于纤维化肺中细胞因子表达的筛选显示,由凋亡的非造血细胞产生的趋化因子Cxcl12对于SatM募集至关重要。纤维化发作时对肺组织的分析显示Rbm7的表达增加,Rbm7是核外泌体靶向复合物的组成部分。Rbm7缺失抑制博来霉素诱导的纤维化,并在细胞水平上抑制非造血细胞的凋亡。从机制上讲,Rbm7与形成亚核小体(包括Neat1斑点)的非编码(nc)RNA结合。Rbm7表达失调导致核降解Neat1斑点,DNA修复蛋白BRCA1的分散以及细胞凋亡的触发。因此,上皮细胞中的Rbm7通过调节ncRNA衰变并由此产生募集SatMs的趋化因子而在纤维化的发展中起关键作用。
当前,尚无用于肺纤维化的有效药物,但是通过针对RBM7基因的研究,将有望开发出高度有效的抗纤维化药物。
参考文献:
http://resou.osaka-u.ac.jp/ja/research/2020/20200318_2
https://www.sciencedirect.com/science/article/abs/pii/S1074761320300789
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号