 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

首页 > 美国看病 > 美国医学前沿 > 阿尔茨海默病新药获批,时隔18年获批新治疗方法
阿尔茨海默病新药获批,时隔18年获批新治疗方法
【本文为疾病百科知识,仅供阅读】 2021-06-09 作者:厚朴方舟
阿尔茨海默病(Alzheimer’s disease,AD)是老年期痴呆常见的一种类型,这是一种退行性脑疾病,可造成思维、记忆和独立性受损,导致患者过早死亡。多年来,阿尔茨海默病的治疗一直处于瓶颈期,自2003年以来便未曾获批过新药物。美国时间6月7日,美国FDA宣布加速审批治疗早期阿尔茨海默病(AD)患者的新药Aduhelm(Aducanumab,阿杜卡玛单抗)上市。这是18年来,FDA批准治疗AD的新方法,也是头款FDA批准的靶向AD潜在疾病机理的新方法。

▲图源:FDA
Aducanumab:从不可能到成功上市
虽然众所周知每一款药物的上市都要历经重重波澜,但是如Aducanumab这般,从看不到成功的希望,到上市成功的却并不多见。
2015年,研究人员开展了两项大规模临床三期试验,评估aducanumab治疗阿尔茨海默病的效果。但2019年3月,试验却因难以达到预期效果而终止。
正当人们以为事情尘埃落定,aducanumab已经没戏的时候,结果180度惊天大逆转又不期而至。
2019年10月,研究人员宣布计划在第二年向FDA递交aducanumab的生物制品申请(BLA),治疗早期阿尔茨海默病(AD)患者。造成这种转折的原因是,研究人员在分析更大的数据集时发现,虽然在临床试验中,aducanumab的效果不明显,但是却能够改善阿尔茨海默病患者的认知能力。
▲图源:abcnews
事实上,在此次Aducanumab上市申请之后,由FDA组织的专家委员会中,几乎所有的专家都对aducanumab投出了反对票,认为没有充分证据证明这款药物治疗阿尔茨海默病的有效性。
但是FDA还是选择批准了Aducanumab的上市。
在此次批准声明中,FDA表示,他们仔细审评了临床试验结果,征求了外周和中枢神经系统药物咨询委员会的意见,也听取了患者群体的观点,确定有实质证据表明,Aducanumab可减少大脑中的β淀粉样斑块,且这些斑块的减少可合理预测患者的重要获益。FDA得出结论,Aducanumab对阿尔茨海默病患者的益处超过风险。
但是FDA也要求研究人员在获得加速批准之后进行确认性临床试验,证明Aducanumab对阿尔茨海默病患者认知能力方面的临床益处。如果验证性试验未能证明预期的临床益处,FDA有可能撤销对这一药物的加速批准。
注:目前比较认可的阿尔茨海默病发病机制是β淀粉样蛋白(amyloid-β,Aβ) 的生成和清除失衡是神经元变性和痴呆发生的始动因素,异常水平的β-淀粉样蛋白在大脑神经元之间形成的斑块具有神经毒性,导致神经元变性。Aducanumab是一种可以与β淀粉样蛋白结合的人源化单克隆抗体,它能够有选择性地与AD患者大脑中的淀粉样蛋白沉积结合,然后通过激活免疫系统,将大脑中的沉积蛋白清除。
阿尔茨海默病多种新治疗方法正在研发中
Aducanumab只是未来5-10年里有望造福患者的多个阿尔茨海默病药物中的头一个。
在2020年ClinicalTrials.gov网站上公布的阿尔茨海默病临床试验中,有29款处于3期临床试验的在研治疗方法,其中不仅包括如Aducanumab一样靶向淀粉样蛋白的药物,还包括神经突触可塑性和神经保护,炎症/感染/免疫力等多个新兴作用机制。
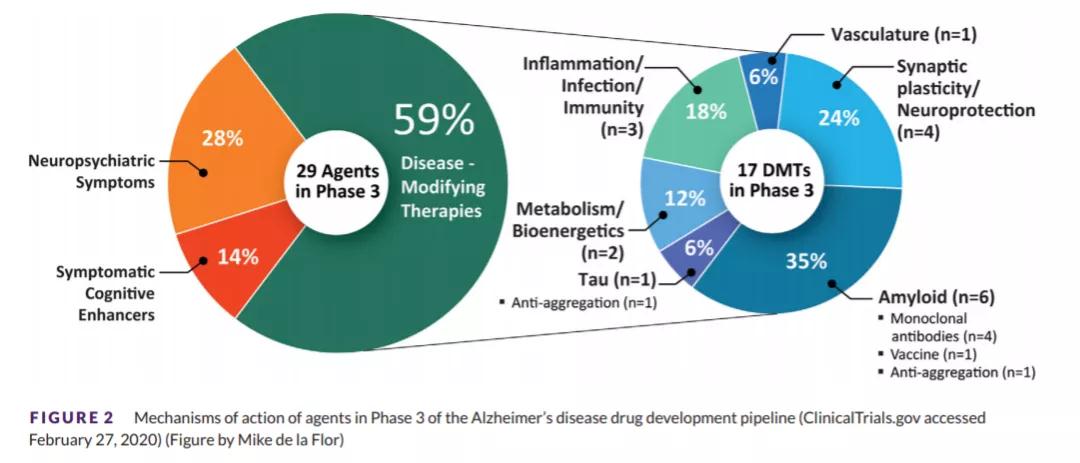
▲处于3期临床试验阶段的AD在研治疗方法具有多种不同的作用机制,图源:[5]
阿尔茨海默病治疗方法的研究也逐渐多元化。
时隔18年的获批,或许会激励整个阿尔茨海默病治疗领域,激发研究人员对创新治疗方法的投入,鼓励更大的创新。此次Aducanumab的获批,或许只是一个开始。未来,将会有更多阿尔茨海默病新药物面世,让更多患者受益。如希望了解更多阿尔茨海默病新药的信息,可拨打热线400-086-8008联系我们
参考来源:
[1] FDA’s Decision to Approve New Treatment for Alzheimer’s Disease
https://www.fda.gov/drugs/news-events-human-drugs/fdas-decision-approve-new-treatment-alzheimers-disease
[2] Alzheimer's Association Welcomes FDA Approval of Aducanumab
https://www.alz.org/news/2021/alzheimers-association-fda-approval-aducanumab
[3] Alzheimer's Drug Discovery Foundation Statement on FDA Approval of Aducanumab
https://www.prnewswire.com/news-releases/alzheimers-drug-discovery-foundation-statement-on-fda-approval-of-aducanumab-301306963.html
[4] Alzheimer's disease drug development pipeline: 2020
https://alz-journals.onlinelibrary.wiley.com/doi/10.1002/trc2.12050
[5] Cummings et al., (2020). Alzheimer’s disease drug development pipeline: 2020. Translational Research & Clinical Interventions. DOI: 10.1002/trc2.12050
[6] Mintun et al., (2021). Donanemab in Early Alzheimer’s Disease. NEJM, DOI: 10.1056/NEJMoa2100708
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:2021年ASCO:胆管癌靶向药物效果公布,生存期显著延长 下一篇:治疗脊柱侧弯新方法!保留脊柱功能,免去青少年手术后遗症
热门服务
推荐阅读
美国权威医学专家
美国医院排名
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号