 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

首页 > 疾病导医 > 癌症肿瘤类 > 肝癌 > 显著提高肝癌治疗效果的5种PD-1/PD-L1免疫治疗药物
显著提高肝癌治疗效果的5种PD-1/PD-L1免疫治疗药物
【本文为疾病百科知识,仅供阅读】 2021-01-21 作者:厚朴方舟
肝癌是发病率较高的恶性肿瘤,根据发表在《柳叶刀·全球健康》(Lancet Global Health)杂志中的一个研究[2]中的数据指出,我国肝癌患者的5 年生存率仅为 12.1%。常用于治疗肝癌的方法为手术治疗、放疗、化疗,但由于很多肝癌患者确诊时已经是中晚期,错失了手术的机会,因此开发新的药物十分关键。在这个背景下,随着研究人员对肝癌发病机制的研究,PD-1/PD-L1免疫药应运而生,为肝癌治疗带来了新的转机。
肝癌PD-1/PD-L1免疫药
目前国内获批的肝癌PD-1/PD-L1免疫药仅有卡瑞利珠单抗(Cabozantinib)和A+T(Tecentriq+Avastin)联合治疗方案,但是帕博利珠单抗(Pembrolizumab)、纳武利尤单抗单药(Nivolumab)以及O+Y(Opdivo+Yervoy)等也已获得FDA批准。
1.卡瑞利珠单抗(Cabozantinib)
2020年3月4日,卡瑞利珠单抗(Cabozantinib)已在中国获批,用于接受过索拉非尼和/或含奥沙利铂系统化疗的晚期肝细胞癌患者的治疗,成为中国初个获批的肝癌免疫治疗药物。卡瑞利珠单抗治疗肝癌的研究结果已发表在《柳叶刀·肿瘤》(Lancet Oncology)杂志中。研究结果显示:截至2018年11月16日,中位随访时间为12.5个月时,14.7%的患者得到有效缓解,55.9%的患者总生存期超过一年[1]。

▲图源:thelancet
2.A+T(Tecentriq+Avastin)联合治疗
2020年5月,美国FDA批准抗PD-L1治疗Tecentriq(特善奇,通用名:atezolizumab,阿特珠单抗)联合Avastin(安维汀,通用名:bevacizumab,贝伐单抗)一线治疗不可切除性肝细胞癌(HCC),A+T联合治疗是初个也是仅有的一个被批准用于治疗不可切除性HCC的癌症免疫治疗方案。同年10月,日本厚生劳动省(MHLW)批准A+T联合治疗肝细胞癌患者,近日,中国NMPA也已批准该治疗方法用于肝细胞癌的治疗。目前该治疗方法已成为不能手术的,肝功能较好的肝细胞癌患者初选。

▲图源:nejm
此次获批基于IMbrave150研究(NCT03434379),结果已发表于国际权威医学期刊《新英格兰医学杂志》(NEJM)中。结果显示,Tecentriq+Avastin联合治疗组总生存期显著延长(中位OS:NE vs 13.2个月)、死亡风险降低42%、一年生存率提高12.6%,疾病无进展生存期延长1.58倍[2]。
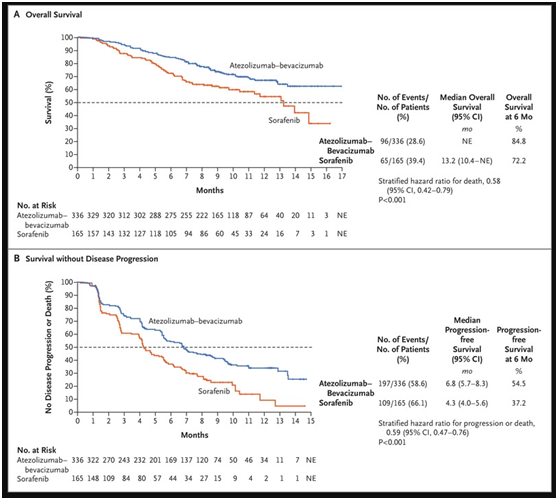
▲总生存率和无进展生存率分析(图源:nejm)
3.帕博利珠单抗(Pembrolizumab)
2018年,美国FDA已批准PD-1肿瘤免疫治疗药物Keytruda(中文商品名:可瑞达,通用名:帕博利珠单抗)一个新的适应症,用于先前已接受靶向药物sorafenib(索拉非尼)治疗的肝细胞癌(HCC)患者。Keytruda HCC适应症的获批,是基于KEYNOTE-224研究的数据,数据显示,Keytruda治疗的17%的患者得到有效缓解。在病情缓解的患者中,89%的患者缓解持续时间(DOR)超过6个月,56%的患者缓解持续时间超过一年[3]。
▲图源:merck
此外,在2020年ASCO年会上,相关研究人员指出,将PD-1治疗药物Keytruda与口服多受体酪氨酸激酶抑制剂Lenvima(通用名:lenvatinib,仑伐替尼)联合用药,可提高不可切除性肝细胞癌(HCC)患者的缓解率,临床试验结果显示,36%的患者得到有效缓解,中位缓解持续时间(DOR)为12.6个月[4]。但目前该治疗方法尚在加速审批中。
4.纳武利尤单抗单药(Nivolumab)
2017年,FDA批准纳武单抗用于先前用索拉非尼治疗过的肝细胞癌患者。此次批准是基于CheckMate-040研究。该队列共入组182例接受过索拉非尼治疗的晚期患者,所有患者分为剂量递增队列(ESC)和扩展队列(EXP),接受纳武单抗治疗。研究结果表明,16%~19%的患者得到有效缓解,中位总生存期为15.6个月,且无论是否有HBV/HCV感染,患者均可获益,研究结果已发表在《柳叶刀·肿瘤》(Lancet Oncology)杂志中[5]。

▲图源:thelancet
5.O+Y(Opdivo+Yervoy)双免疫治疗
2020年3月11日,美国FDA已批准纳PD-1抑制剂Opdivo(nivolumab),与CTLA-4抑制剂Yervoy(ipilimumab)联用,治疗既往接受过索拉非尼治疗的肝细胞癌(HCC)患者,这是FDA批准的针对该患者群的初个也是仅有的双重免疫治疗。

▲图源:news.bms
此次获批基于CheckMate -040临床试验,结果显示,经过至少28个月的随访,纳武利尤单抗联合伊匹木单抗在既往接受过索拉非尼治疗的肝细胞癌患者队列中的治疗33%的患者得到有效缓解,缓解持续时间为4.6至30.5个月以上,88%的患者缓解持续时间超过6个月,56%的患者缓解持续时间超过1年,31%的患者缓解持续时间超过2年[6]。
除了以上获批的免疫治疗药物,研究人员还正在研究诸如替雷利珠单抗(Tislelizumab)、信迪利单抗(Sintilimab)+IBI305(贝伐珠单抗生物类似药)、特瑞普利单抗(toripalimab)、D+T双免疫治疗(PD-L1单抗Durvaluamb(德瓦鲁单抗)联合CTLA-4单抗tremelimumab)等免疫药物在肝癌中的效果,有望进一步提高肝癌的生存率。
回望2020年,虽然世界都笼罩在疫情肆虐的阴影下,但医学研究的脚步并未停止,肝癌免疫治疗的临床试验层出不穷,为肝癌患者的治疗提供了更多可能。目前,针对肝癌治疗方法的探索仍未停歇,期待未来将会有更多的肝癌药物出现。如想了解更多肝癌治疗的新进展,可通过热线电话400-086-8008与厚朴方舟联系。
参考来源:
[1] Qin S, Ren Z, Meng Z, Chen Z, Chai X, Xiong J, Bai Y, Yang L, Zhu H, Fang W, Lin X, Chen X, Li E, Wang L, Chen C, Zou J. Camrelizumab in patients with previously treated advanced hepatocellular carcinoma: a multicentre, open-label, parallel-group, randomised, phase 2 trial. Lancet Oncol. 2020 Apr;21(4):571-580. doi: 10.1016/S1470-2045(20)30011-5. Epub 2020 Feb 26. PMID: 32112738.
[2]Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma
Richard S. Finn, M.D., Shukui Qin, M.D., Masafumi Ikeda, M.D., Peter R. Galle, M.D., Michel Ducreux, M.D., Tae-You Kim, M.D., Masatoshi Kudo, M.D., Valeriy Breder, M.D., Philippe Merle, M.D., Ahmed O. Kaseb, M.D., Daneng Li, M.D., Wendy Verret, Ph.D., et al., for the IMbrave150 Investigators*
[3]FDA Approves Merck’s KEYTRUDA® (pembrolizumab) for the Treatment of Patients with Hepatocellular Carcinoma (HCC) Who Have Been Previously Treated with Sorafenib
[4]Eisai and Merck Receive Complete Response Letter for LENVIMA® (lenvatinib) plus KEYTRUDA® (pembrolizumab) Combination as First-Line Treatment for Unresectable Hepatocellular Carcinoma
[5]Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial
Crossref DOI link: https://doi.org/10.1016/S0140-6736(17)31046-2
[6]Opdivo Prescribing Information. Opdivo U.S. Product Information. Last updated: March 2020. Princeton, NJ: Bristol Myers Squibb Company.
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号