今天,辉瑞公司宣布美国食品和药物管理局(FDA)批准了
VIZIMPRO!作为一线治疗方法,治疗非小细胞肺癌患者。携带EGFR基因外显子19缺失或外显子21 L858R置换突变的转移性非小细胞
肺癌(NSCLC)患者肿瘤中携带的突变都已通过FDA批准的诊断测试得到确认。
肺癌是世界范围导致癌症死亡的首要原因之一,转移性非小细胞肺癌占肺癌总数的85%。据统计75%的NSCLC患者在确诊时癌症已经转移或处于晚期,他们的5年生存率只有5%。EGFR是一种帮助细胞生长和分裂的蛋白。当EGFR基因发生突变后,它会导致蛋白过度活跃,从而导致癌细胞的生成。EGFR基因突变出现在10-35%的NSCLC患者中,较常见的激活性突变为外显子19缺失和外显子21 L858R置换,它们占已知激活性EGFR突变的80%。对于这类肿瘤的治疗仍然是一个重大挑战。
这一批准是基于Vizimpro在名为ARCHER 1050的随机多中心国际性开放标签3期临床研究的结果。总计452名患者被随机分为两组,接受Vizimpro或者活性对照的治疗。该试验的主要终点为由独立的放射学审查委员会(IRC)评估的无进展生存期(PFS)。根据IRC评估的PFS,Vizimpro与活性对照相比,显著延长了患者的中位PFS(p<0.0001)。Vizimpro治疗组PFS为14.7个月(95% CI: 11.1, 16.6),活性对照组为9.2个月(95% CI: 9.1, 11.0)。
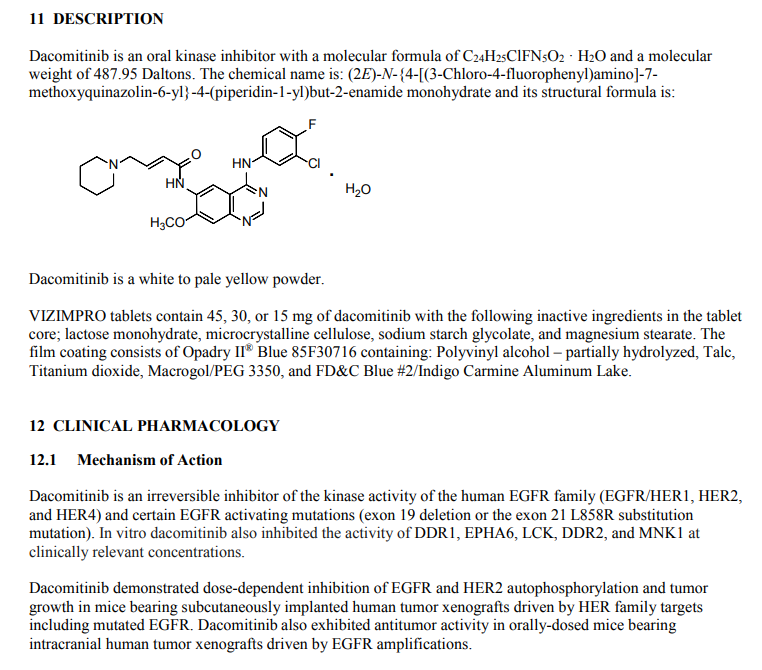
Vizimpro是辉瑞公司开发的口服药,不可逆的人体表皮生长因子受体(HER)酪氨酸激酶抑制剂。该药物获得了FDA授予的优先审评资格。
关于VIZIMPRO®(dacomitinib)
VIZIMPRO是一种激酶抑制剂,适用于转移性非小细胞肺癌治疗,表皮生长因子受体(EGFR)外显子19缺失或外显子21 L858R替代突变,经FDA批准的检测。VIZIMPRO在FDA的优先审查计划下得到审查和批准。
介绍剂量的VIZIMPRO口服45毫克,每日一次。如果需要减少剂量,那么靠前次剂量应该减少为每天一次30毫克,第二次应该减少剂量为每天一次15毫克。
VIZIMPRO没有禁忌症!
VIZIMPRO治疗肺癌的副作用详情:
间质性肺病(ILD):用VIZIMPRO治疗的患者可能发生严重和致命的ILD /肺炎,在394名VIZIMPRO治疗的患者中发生率为0.5%; 0.3%的病例是致命的。监测患者的肺部症状,指示ILD /肺炎。扣留VIZIMPRO并及时调查患有呼吸系统症状恶化的患者的ILD,这可能表明ILD(例如,呼吸困难,咳嗽和发烧)。如果ILD得到确认,则长久停止VIZIMPRO。
腹泻:用VIZIMPRO治疗的患者发生严重和致命的腹泻。在394名VIZIMPRO治疗的患者中,86%发生腹泻。11%的患者报告有3级或4级腹泻,0.3%的患者是致命的。扣留VIZIMPRO治疗2级或更vip别的腹泻,直至恢复至小于或等于1级严重程度,然后根据腹泻的严重程度以相同或减少的剂量恢复VIZIMPRO。及时开始抗腹泻治疗(洛哌丁胺或盐酸地芬诺酯与硫酸阿托品)治疗腹泻。
皮肤病学不良反应:用VIZIMPRO治疗的患者发生皮疹和剥脱性皮肤反应。在394名VIZIMPRO治疗的患者中,78%发生皮疹。21%的患者报告有3级或4级皮疹。7%的患者报告任何严重程度的剥脱性皮肤反应。1.8%的患者报告了3级或4级剥脱性皮肤反应。扣留VIZIMPRO持续2级或任何3级或4级皮肤病不良反应,直至恢复至1级以下严重程度,然后根据皮肤病不良反应的严重程度,以相同或减少的剂量恢复VIZIMPRO 。皮疹和剥脱性皮肤反应的发生率和严重程度可能会随着阳光照射而增加。在VIZIMPRO开始时,开始使用保湿剂和适当的措施来限制阳光照射。在发展1级皮疹后,开始使用局部抗生素和局部类固醇治疗。开始口服抗生素治疗2级或更严重的皮肤病学不良反应。
孕妇:当给孕妇服用时,VIZIMPRO会对胎儿造成伤害。建议孕妇对胎儿有潜在风险。建议具有生殖潜力的女性在使用VIZIMPRO治疗期间使用有效避孕措施,并在较终剂量后至少17天使用有效避孕措施。
不良反应:较常见(> 20%)的不良反应是腹泻(87%),皮疹(69%),甲沟炎(64%),口腔炎(45%),食欲下降(31%),皮肤干燥(30%) ),体重减轻(26%),脱发(23%),咳嗽(21%)和瘙痒(21%)。较常见(≥1%)的严重不良反应是腹泻(2.2%)和间质性肺病(1.3%)。
VIZIMPRO治疗肺癌时药物相互作用:
伴随使用质子泵抑制剂(PPI)可降低达克替尼浓度,这可能会降低VIZIMPRO的效果。避免与VIZIMPRO同时使用PPI。作为PPI的替代品,使用局部作用的抗酸剂或H2受体拮抗剂。在服用H2受体拮抗剂之前至少6小时或10小时后给予VIZIMPRO。同时使用VIZIMPRO会增加CYP2D6底物药物的浓度,从而增加这些药物毒性的风险。避免同时使用VIZIMPRO与CYP2D6底物,其中CYP2D6底物浓度的较小增加可能导致严重或危及生命的毒性。
哺乳期:由于VIZIMPRO母乳喂养婴儿可能出现严重不良反应,建议女性在使用VIZIMPRO治疗期间至少17天后不要进行母乳喂养。
肝功能损害:轻度或中度肝功能损害患者不建议调整剂量。对于严重肝功能不全的患者,尚未建立VIZIMPRO的介绍剂量。
肾功能损害:对于轻度或中度肾功能不全患者,建议不要调整剂量。尚未确定严重肾功能不全的患者可使用VIZIMPRO介绍剂量。
附:VIZIMPRO配方:https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/211288s000lbl.pdf
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:美国FDA批准抗癌新药,治疗三种淋巴瘤
下一篇:2021肺癌获批新药汇总 FDA批准5款肺癌新药 效果显著
 全球服务热线:400-086-8008
全球服务热线:400-086-8008 全球服务热线:400-086-8008
全球服务热线:400-086-8008
 全球咨询服务热线
全球咨询服务热线
