 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

首页 > 美国看病 > 美国新药资讯 > 美国FDA新批准治疗白血病药物!
美国FDA新批准治疗白血病药物!
【本文为疾病百科知识,仅供阅读】 2018-11-29 作者:厚朴方舟
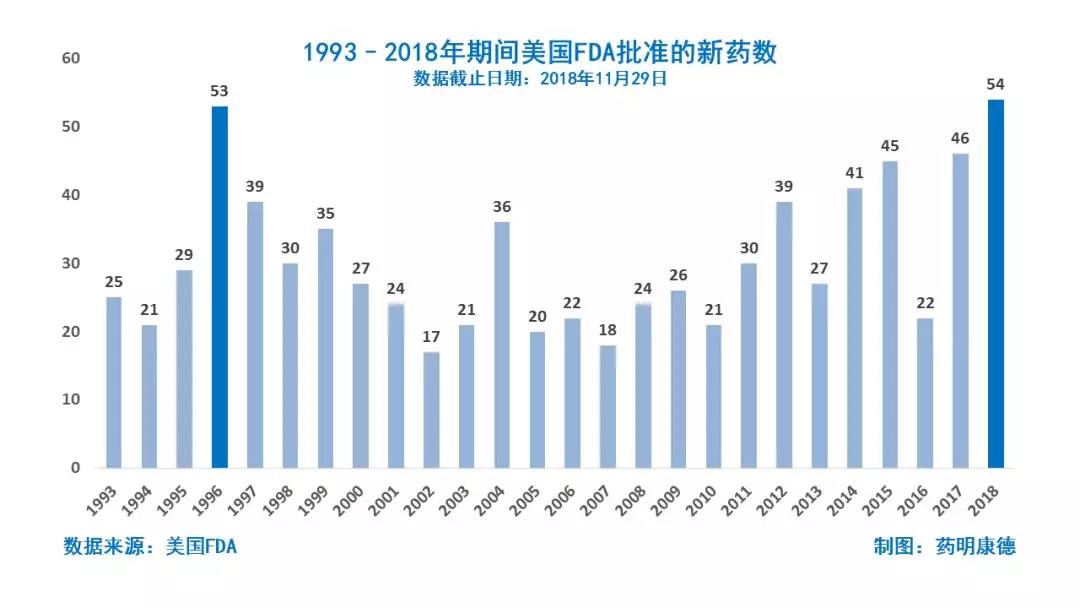
今日,美国FDA宣布,批准安斯泰来(Astellas Pharma)公司的Xospata(gilteritinib)上市,用于治疗携带FLT3基因突变的复发/难治性急性骨髓性白血病(AML)成人患者(约占患者总数的三分之一)。这些患者的基因突变需要被FDA批准的伴随诊断确认。值得注意的是,这是美国FDA今年批准的第54款新药,打破了FDA年度批准新药数目的历史纪录。

AML是一种疾病进展迅速的血液癌症,癌变细胞不断的增殖和积累,会导致正常细胞的生成受阻,患者需要持续接受输血。大约25-30%的AML患者在FLT3基因上携带突变,这些基因突变通常与侵袭性更强的肿瘤相关,患者癌症复发的风险更大。据美国国家癌症研究所(NCI)统计,在2018年大约有19520名新确诊的AML患者,大约10670名AML患者会因此去世。
Xospata是安斯泰来公司开发的的FLT3酪氨酸激酶抑制剂,它能够对携带FLT3-ITD基因变异和FLT3酪氨酸激酶蛋白域基因变异的FLT3产生抑制作用。这两种常见的FLT3基因变异出现在大约三分之一的AML患者中。而且,Xospata还能够在AML细胞系中抑制AXL受体的活性。FDA曾授予该药物快速通道、孤儿药和优先审评资格。
Xospata的批准是基于该药物在一项包含138名患者的临床试验中的表现。在这些确认携带FLT3基因突变的AML患者中,21%接受治疗的患者达到完全缓解或者完全缓解加血液学部分恢复。在接受Xospata治疗前,106名患者需要接受输入血红细胞或者血小板,接受药物治疗白血病后,这些患者中31%至少56天内不再需要输血。
“这一批准将为高危AML患者带来一款高度有效且耐受性良好的治疗选择。这些患者在今天之前除了化疗以外,没有有针对性的治疗方法。”该药物临床试验负责人,宾夕法尼亚大学血液学-肿瘤学教授Alexander Perl博士说。
我们祝贺这款新药顺利上市,为AML白血病患者造福。2018年还剩下一个月,而美国FDA批准的新药数目已经突破了历史纪录,在接下来的一个月里,这一新纪录还可能被不断打破。
2018年至今获批新药简介
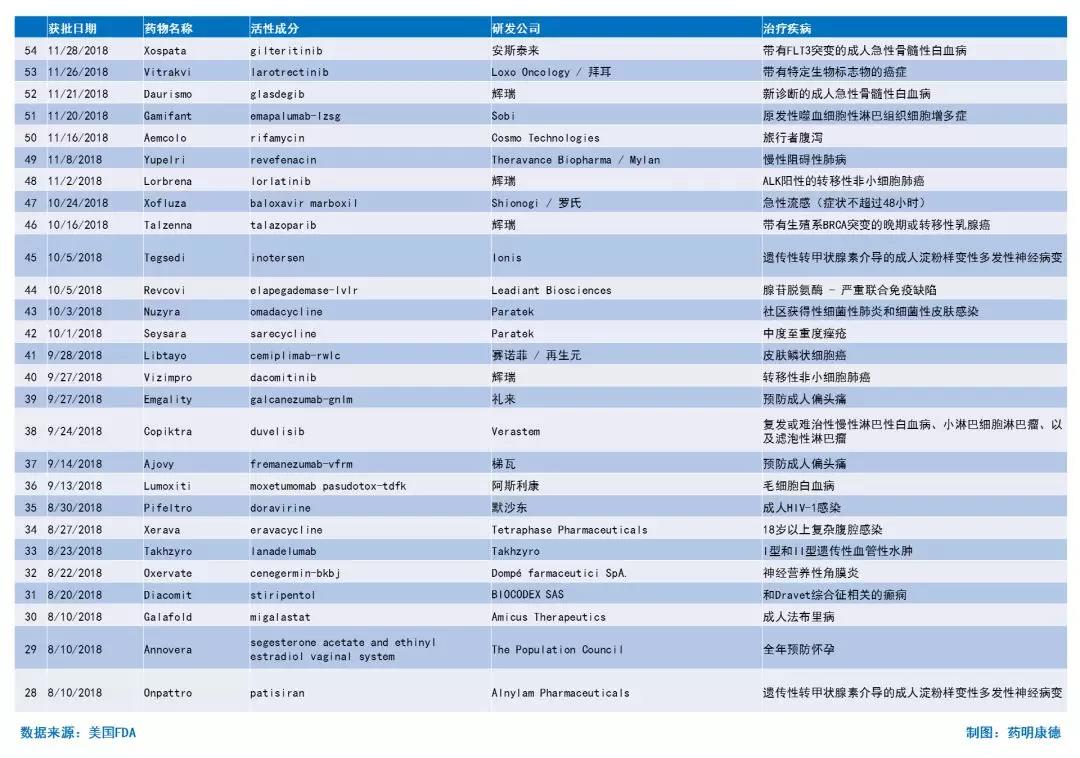
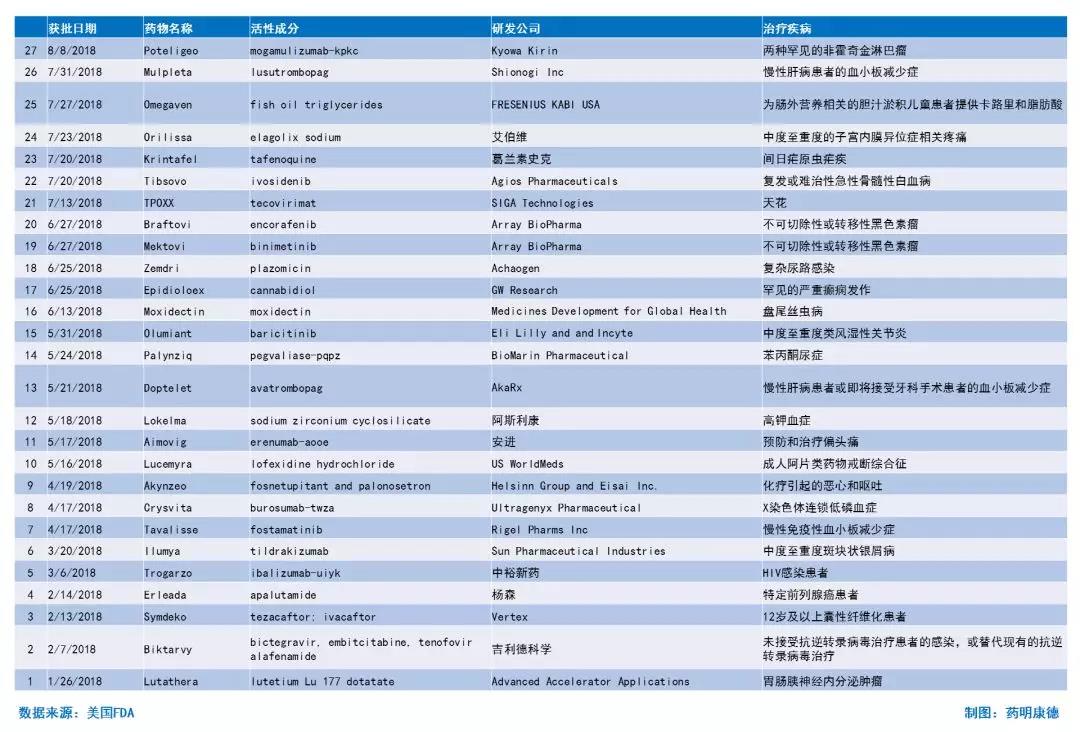
来源:药明康德(侵删)
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:FDA批准劳拉替尼Lorbrena(Lorlatinib)治疗非小细胞肺癌! 下一篇:初款Lambert-Eaton肌无力综合征新药美国获批上市
热门服务
推荐阅读
美国权威医学专家
美国医院排名
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号