近日,美国食品和药物管理局(FDA)已批准Elzonris(tagraxofusp-erzs,SL-401),用于2岁及以上母细胞性浆细胞样树突状细胞肿(BPDCN)儿科患者和成人患者的治疗,包括既往未接受治疗(初治)和既往已接受治疗(经治)的BPDNC患者。值得一提的是,此次批准,使Elzonris成为 获批治疗BPDCN的药物,同时也是 获得批准的CD123靶向药物。
Elzonris的获批,是基于在初治和经治BPDCN患者中开展的一项多中心、多队列、开放标签、单臂研究(STML-401-0114;NCT02113982)的数据。靠前队列中,13例初治BPDCN患者接受了Elzonris标签剂量和时间表治疗,7例(54%)实现完全缓解或临床完全缓解(CR/CRc),中位CR/CRc持续时间未达到(范围:3.9个月-12.2个月)。第2队列中,15例复发性或难治性BPDCN患者接受了Elzonris治疗,1例实现CR缓解,1例实现CRc缓解。
Elzonris临床研究的首席研究员、美国德克萨斯大学MD安德森癌症中心副教授Naveen Pemmaraju表示,“Elzonris的获批,是BPDCN患者临床治疗向前迈出的重要一步。CD123在BPDCN和许多其他血液恶性肿瘤中表达,Elzonris是一种CD123靶向治疗方法,该药的批准将为BPDCN患者提供一种新的护理标准。”
Elzonris临床研究的首席研究员、哈佛医学院和达纳-法伯癌症研究所助理教授Andrew Lane表示,“Elzonris代表着BPDCN治疗从来没有过的飞跃,这是一种迄今为止还没有批准治疗方案的侵袭性恶性肿瘤。在临床研究中,有许多患者接受Elzonris治疗后经历了显著的缓解,其中一部分患者在缓解后接受了干细胞移植。”
Elzonris(tagraxofusp)的作用机制(图片来源,Stemline公司网站)
BPDCN是一种侵袭性、罕见性血液系统恶性肿瘤,预后不佳,这是一个医疗需求未满足的治疗领域。BPDCN的特征可能与某些疾病相似,也可能被误诊为某些疾病,包括急性髓性
白血病(AML)、非
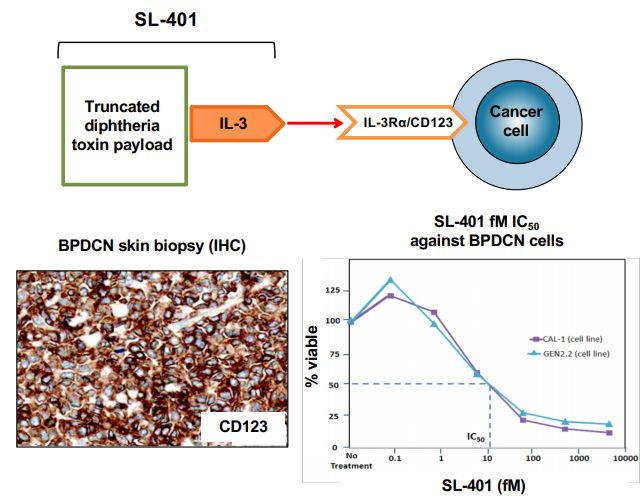
霍奇金淋巴瘤(NHL)、急性淋巴细胞白血病(ALL)、骨髓增生异常综合症、慢性粒细胞性白血病(CML)以及其他具有皮肤表现的恶性肿瘤。BPDCN通常存在于骨髓和/或皮肤,也可能涉及淋巴结和内脏。BPDCN的诊断基于CD123、CD4、CD56的免疫诊断三联体。CD123(IL-3R)是识别BPDCN的一个关键标志物,并且是各种癌症治疗研究中的一个迅速出现的靶点。
Elzonris是一种CD123导向的细胞毒素,专门针对CD123靶点设计,该药由人IL-3与截短的白喉毒素(DT)进行重组融合而成,IL-3结构域能够将细胞毒性DT片段引导至表达CD123的肿瘤细胞。在被肿瘤细胞内化后,Elzonris能够不可逆地抑制蛋白质合成并诱导靶细胞凋亡。
在美国,Elzonris已被授予突破性药物资格(BTD)、孤儿药资格(ODD),同时通过FDA的优先审查程序进行了审批。在欧盟,Elzonris已被授予加速审批,预计将在2019年靠前季度获得批准。目前,也正在评估Elzonris治疗其他适应症,包括慢性骨髓单核细胞性白血病(CMML)、骨髓纤维化(MF)及其他适应症。
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:美国批准新药Asparlas一线治疗儿童急性淋巴性白血病
下一篇:2018年美国FDA批准治疗肺癌的新药物
 全球服务热线:400-086-8008
全球服务热线:400-086-8008 全球服务热线:400-086-8008
全球服务热线:400-086-8008
 全球咨询服务热线
全球咨询服务热线
