 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

美国看病-美国又有乳腺癌新药获得FDA优先审批资格!
【本文为疾病百科知识,仅供阅读】 2016-11-03 作者:厚朴方舟
高达三分之一的早期乳腺癌患者可能随后恶化成转移性状态。转移性乳腺癌是该疾病的较严重形式之一,此时癌症细胞已经扩散到脑、骨骼或肝脏等身体其他部位。晚期乳腺癌包括转移性乳腺癌(4期)和晚期乳腺癌(3期)。晚期乳腺癌妇女患者的生存率远低于早期疾病阶段病人的生存率:3期乳腺癌的5年相对生存率约为72%,而转移性(4期)乳腺癌的5年相对生存率只约为22%。
据海外医疗领导品牌厚朴方舟了解,诺华宣布美国FDA接受了该公司的NDA申请,批准了LEE011(ribociclib)的优先审评资格(Priority Review)——与来曲唑组合,一线治疗那些激素受体阳性、人表皮生长因子受体2阴性(HR+/HER2-)的晚期或转移性乳腺癌的绝经后妇女患者。同时,诺华公司还宣布,EMA已接受审查ribociclib和来曲唑在同一患者人群的上市授权申请。给乳腺癌患者带来了新希望。
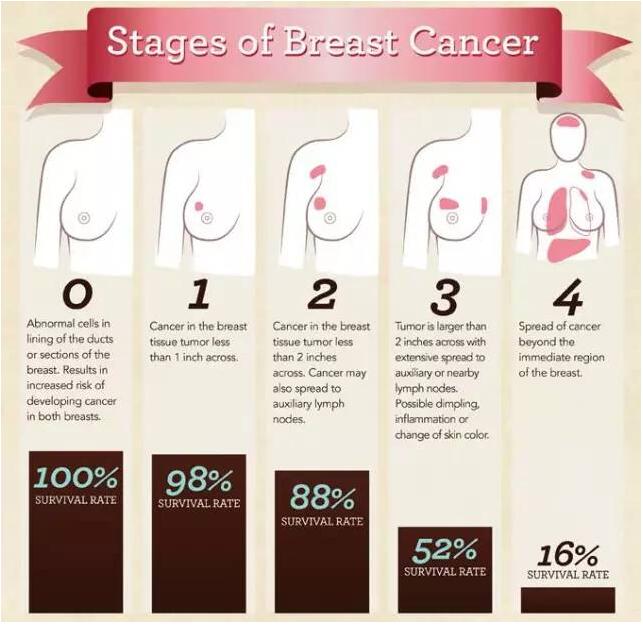
▲乳腺癌的不同阶段
内分泌治疗是绝经后激素受体阳性,HER2阴性晚期乳腺癌患者标准治疗,其中芳香化酶抑制剂(AI)是选择的一线方案。然而,绝大多数患者在治疗后都会出现内分泌抵抗和疾病进展,因此延长或重建内分泌治疗敏感性是一个重要的治疗思路。CDK4/6抑制剂可有效地克服或延迟内分泌抵抗的出现,为晚期患者争取更多的生存时间。
随机双盲Ⅲ期研究MONALEESA-2的期中分析结果显示,Ribociclib+来曲唑一线联合方案相较于来曲唑+安慰剂方案,PFS提高44%。
作为该试验的主要研究者,MD安德森癌症中心的Gabriel Hortobagyi教授说:“这是一项确定性研究,证实了Ribociclib联合来曲唑效果优于单药来曲唑。”
这次NDA申请是基于一系列全面的临床数据,包括了MONALEESA-2试验的结果。MONALEESA-2是一项3期随机、双盲、安慰剂对照的多中心全球登记临床试验,用于评估ribociclib联合来曲唑与来曲唑单独使用的不受威胁性和效果,治疗绝经后HR+/HER2-晚期乳腺癌女性。该试验数据结果在2016年欧洲医学肿瘤学会(ESMO)大会上得以报告,并同时发表在《新英格兰医学》杂志上,显示ribociclib联合来曲唑可使疾病进展或死亡的风险降低44%(HR=0.556,95% CI:0.429-0.720;P=0.00000329),显著延长所有患者亚组的无进展生存期(PFS)。
诺华肿瘤的首席执行官Bruno Strigini先生表示:“这些监管层面的里程碑成功,以及8月份FDA授予的突破性治疗方法认定,强调了HR+/HER2-晚期乳腺癌女性需要新的治疗选择。与FDA的标准审评程序相比,优先审评可允许更短的审查期,帮助我们更快地把LEE011+来曲唑这一有效方案提供给患者。我们还正在与EMA以及其他国家的医药卫生监管部门一起努力,尽早造福全世界患者。”
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:美国看病- 肌萎缩症药物获FDA破格批准 下一篇:美国看病-安进抗炎药Enbrel获美国FDA批准治疗儿科斑块型银屑病
热门服务
推荐阅读
美国权威医学专家
美国医院排名
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号