 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

Keytruda获FDA优先审评资格及突破性治疗方法认定
【本文为疾病百科知识,仅供阅读】 2016-09-09 作者:厚朴方舟
海外医疗领导品牌厚朴方舟前沿消息,美国制药公司默沙东宣布,美国FDA已经授予了其免疫治疗方法方法产品Keytruda(pembrolizumab)补充生物制剂许可申请(sBLA)的优先审评资格。Keytruda是该公司的抗PD-1上市明星药物,此次的适应症是一线治疗患有PD-L1阳性表达的晚期非小细胞肺癌(NSCLC)病人。
此外,美国FDA还授予了Keytruda一线治疗肺癌适应症的突破性治疗方法认定。这是继接受Yervoy+BRAF V600抑制剂治疗后疾病进展或不可手术切除的晚期黑色素瘤、经治疗的转移性NSCLC、晚期黑色素瘤、微卫星不稳定性和高转移性结直肠癌和复发性或难治性经典霍奇金淋巴瘤之后,Keytruda获得的第6个突破性治疗方法认定。
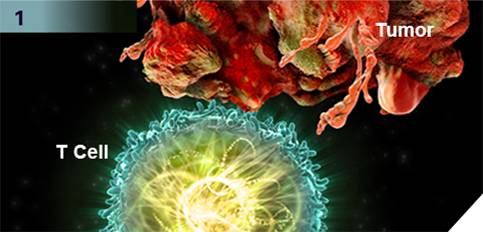
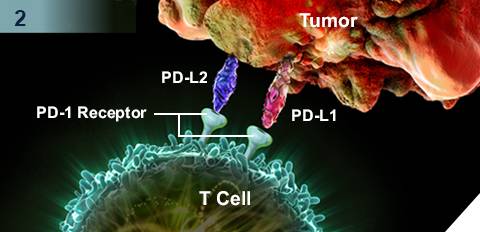
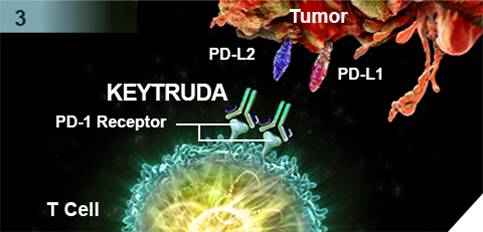
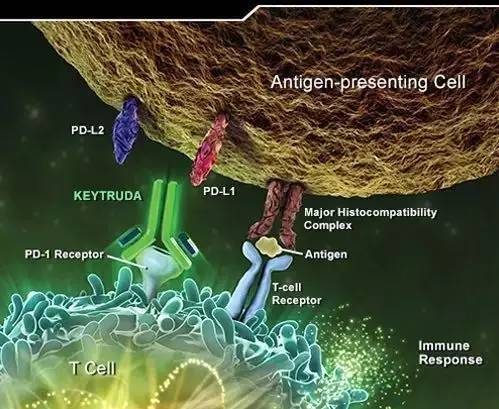
▲Keytruda的作用机理
Keytruda是人源化单克隆抗体,通过提高机体的免疫系统能力来帮助检测和抵抗肿瘤细胞。 其作用机制是阻断PD-1与配体PD-L1/PD-L2之间的结合,从而激活T淋巴细胞进而狙击体内的肿瘤细胞。Keytruda是美国FDA批准的前列个PD-1免疫检查点抑制剂,目前治疗适应症包括黑色素瘤、肺癌和头颈部肿瘤。

▲Keytruda的适应症
本次针对一线治疗PD-L1阳性晚期NSCLC适应症的申请是基于一项关键性3期临床研究(KEYNOTE-024)的积极数据。该研究在肿瘤高水平表达PD-L1(定义为肿瘤比例得分TPS≥50%)的初治晚期NSCLC患者中开展,评估了Keytruda作为单药治疗方法,与含铂化疗标准护理(SOC)相比较的效果和不受威胁性。数据显示,与标准化疗相比,Keytruda在主要终点(无进展生存期)和次要终点(总生存期)方面均表现出显著性提高。基于这些卓越结果,一个独立的数据监测委员会已建议提前终止研究,并且目前在临床试验里接受化疗的患者有机会改用Keytruda继续治疗。申请一线治疗该适应症的剂量为每三周200毫克,与KEYNOTE-024所使用的剂量一致。同时,默沙东还向欧盟药品管理局(European Medicines Agency)提交了用于此适应症的营销授权申请(Marketing Authorization Application)。
默沙东研究实验室总裁Roger M. Perlmutter博士说道:“几十年来化疗一直是一线治疗NSCLC的基础,所以在高PD-L1表达患者中看到接受Keytruda治疗后生存显著改善是个非常好的消息。我们很高兴有机会与监管部门合作,促使Keytruda成为针对NSCLC的一线治疗方案。”
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:美国看病-MIT科学家放下身段改进开源3D打印假手 下一篇:美国收获Destiny Pharma抗菌药XF-73试验数据
热门服务
推荐阅读
美国权威医学专家
美国医院排名
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号