 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

基因泰克PD-L1单抗取得关键性肺癌3期临床成功
【本文为疾病百科知识,仅供阅读】 2016-10-11 作者:厚朴方舟
“只为更好医疗”的出国看病领导品牌厚朴方舟获悉,在2016年欧洲肿瘤医学学会(ESMO)上,基因泰克公布了atezolizumab的关键性肺癌3期临床试验数据:与化疗相比,atezolizumab显著延长了患者的生存期中位数,这也达到了这项试验的共同主要临床终点。
非小细胞肺癌占了所有肺癌的85%,有着庞大的患者基数。在美国,光在2016年就将有超过22.4万的美国人被诊断患有肺癌,而且大约60%确诊的肺癌已处于晚期阶段。在晚期肺癌面前,传统的治疗手段往往显得捉襟见肘。
基因泰克公司的上市产品atezolizumab是可与PD-L1蛋白相结合的单克隆抗体,当它结合肿瘤细胞和肿瘤浸润免疫细胞中表达的PD-L1时,可同时阻断该表面分子与PD-1受体以及B7.1受体之间的相互作用。通过抑制PD-L1的功能,atezolizumab可以活化T细胞的免疫应答来攻击癌细胞。目前,atezolizumab是FDA批准的前列个,也是专门一个抗PD-L1的肿瘤免疫治疗方法方法。今年,它以商品名Tecentriq上市,适应症是癌症进入晚期,或肿瘤已发生转移的尿路上皮癌(较常见的膀胱癌)患者。
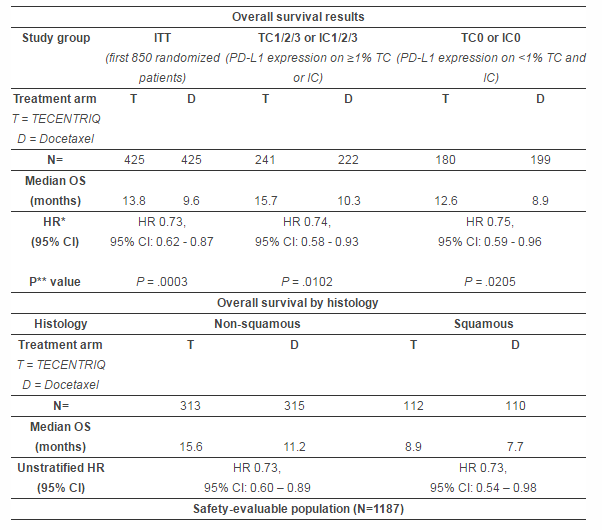
▲本次基因泰克公布的数据
在一项以非小细胞肺癌为适应症的3期临床试验中,研究人员募集了1225例经铂类药物化疗后,疾病依旧出现进展的晚期或转移性非小细胞肺癌患者。该研究纳入的病人不区分程序性死亡配体1(PD-L1)水平状态,并同时包括了鳞状和非鳞状疾病类型。研究发现,和传统化疗方式相比,atezolizumab能延长生存期中位数长达4.2个月(中位总生存[OS]:13.8对9.6个月;HR=0.73,95%CI:0.62-0.87),不受威胁性数据则与既往研究一致。
近期,美国FDA已经授予了atezolizumab突破性治疗方法认定,用于治疗接受铂类药物化疗后,疾病发生进展的PD-L1阳性非小细胞肺癌患者。针对该适应症的生物制品许可申请(BLA)已获得FDA优先审评,预定审批期限为2016年10月19日。基因泰克公司目前共开展了8项评估atezolizumab作为单独治疗方法或与其他治疗方法联用治疗早期和晚期非小细胞肺癌患者的临床研究。
“Tecentriq是前列个也是专门获批的抗PD-L1肿瘤免疫药物,有望帮助那些患有转移性非小细胞肺癌的病人,而且不用区分他们体内PD-L1的表达水平或他们的疾病组织学数据,”基因泰克公司的首席医疗官兼全球产品开发的负责人Sandra Horning博士说道:“PD-L1表达量很低,甚至没有表达的病人也能从此药治疗中获得显著效果。”
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
热门服务
推荐阅读
日本权威医学专家
日本医院排名
服务案例更多>
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号