 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

2022年5月至7月新药盘点丨多款创新疗法获批,涉及食管癌、白血病、淋巴瘤、卵巢癌等
【本文为疾病百科知识,仅供阅读】 2022-07-05 作者:厚朴方舟
为了提高癌症治疗的效果,研究人员不断探索癌症治疗的创新药物方案。那么,2022年5月-6月又有哪些创新药物取得新进展?7月又将有哪款药物有望获批?

▲图源:integratedhealthclinic
一、两款用于食道癌的免疫联合方案获FDA批准,显著延长生存期
美国FDA批准两种基于PD-1抑制剂Opdivo的组合方案:Opdivo与含氟嘧啶和含铂化疗联用;Opdivo与抗CTLA-4抗体Yervoy联用,作为一线方案治疗晚期不可切除或转移性食管鳞状细胞癌。

▲图源:参考来源[1]
这一批准是基于3期临床试验CheckMate-648的积极结果。研究结果显示,两种Opdivo联合方案一线治疗食道癌均显著延长了患者的生存期,具体数据为:
Opdivo联合化疗一线治疗食道癌,在肿瘤表达PD-L1的患者中,中位总生存期为15.4个月,化疗为9.1个月,中位无进展生存期为6.9个月,化疗为4.4个月;在所有随机患者群体中,中位总生存期为13.2个月,化疗为10.7个月,中位无进展生存期为5.8个月,化疗为5.6个月。
Opdivo联合Ipilimumab的双免疫方案,在肿瘤表达PD-L1的患者中,中位总生存期为13.7个月,化疗为9.1个月;而在全随机患者群体中,中位总生存期为12.8个月,化疗为10.7个月。
二、淋巴瘤创新方案初次于日本获批,缓解率高达71%
今年6月,日本厚生劳动省(MHLW)已批准有机砷药物Darvias(Darinaparsin,曾用名SP-02)上市,用于治疗复发或难治性外周T细胞淋巴瘤(PTCL),成为外周T细胞淋巴瘤治疗的重要选择!

▲图源:参考来源[2]
发表在《Japanese Journal of Clinical Oncology》1期临床试验纳入了14例复发或难治性外周T细胞淋巴瘤的患者。研究结果显示,Darvias治疗的缓解率为71.43%,其中7%的患者经过Darvias治疗后获得完全缓解(1例),21%的患者获得部分缓解(3例),43%的患者疾病稳定(6例)。
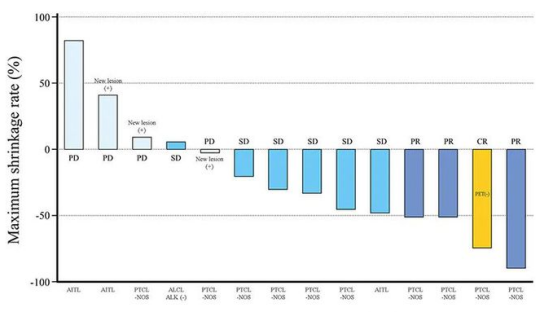
▲图源:参考来源[3]
三、急性髓细胞白血病靶向方案获FDA批准,延长生存期3倍以上
今年5月美国FDA已批准IDH1抑制剂Tibsovo(ivosidenib )与阿扎胞苷联用,一线治疗年龄超过75岁,或由于合并症无法接受强力诱导化疗的携带IDH1突变的急性髓细胞白血病(AML)患者。

▲图源:参考来源[4]
3期临床试验AGILE结果显示,Tibsovo联合阿扎胞苷组的患者在12个月无事件生存率为37%,而对照组仅为12%;Tibsovo联合阿扎胞苷组的中位总生存期为24个月,而对照组仅为,7.9个月,总生存期延长三倍以上!
四、用于胶质瘤、胆管癌等20多种癌症的创新方案获FDA加速批准
今年6月,美国FDA加速批准BRAF抑制剂Tafinlar(dabrafenib,达拉非尼)+MEK抑制剂Mekinist(trametinib,曲美替尼)的组合方案,用于治疗接受前期方案后疾病出现进展并且没有满意的替代治疗选择的,携带BRAF V600E的无法切除或转移性实体瘤成人和6岁以上儿科患者。Tafinlar+Mekinist是初款获批不限癌种治疗BRAF V600E实体瘤的BRAF/MEK抑制剂,也是BRAF/MEK抑制剂初次获批用于儿科患者。

▲图源:参考来源[5]
此次FDA的加速批准是基于三项临床试验中展示的安全性和临床效果结果。研究结果显示,Tafinlar+Mekinist治疗携带BRAF V600E的实体瘤患者(包括高.级别和低级别胶质瘤、胆管癌、妇科癌症以及胃肠道癌症)缓解率达到80%;Tafinlar+Mekinist治疗低级别脑胶质瘤的缓解率为47%。
五、卵巢癌靶向方案获FDA优先审评资格
美国FDA已授予靶向叶酸受体α(FRα)的抗体偶联药物(ADC)mirvetuximab soravtansine作为单药方案,治疗FRα高表达,对含铂方案耐药的经治晚期卵巢癌患者的优先评审资格,mirvetuximab soravtansine有望成为初款卵巢癌ADC药物[6]。

▲图源:参考来源[1]
这一优先审评资格基于一项关键性3期临床试验SORAYA的结果。该研究纳入了106例肿瘤表达高水平FRα的含铂药物耐药卵巢癌患者。研究结果显示,采用mirvetuximab soravtansine治疗后的缓解率(ORR)为32.4%,中位缓解持续时间(DOR)为6.9个月,中位无进展生存期(PFS)为4.3个月。
六、7月,这款抗癌药物有望获批
Tislelizumab是一种靶向PD-1的人源化IgG4单克隆抗体,基于3期临床试验的积极数据,FDA于2021年9月接收了Tislelizumab的生物制品许可申请(BLA),截止日期设定为2022年7月12日。
RATIONALE 306研究结果显示,不论患者PD-L1表达状态如何,Tislelizumab+化疗的组合方案都将不可切除的、复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者的死亡风险显著降低[7]。
研究结果显示,采用Tislelizumab联合化疗治疗后,食管癌患者的中位总生存期达到17.2个月,而对照组仅为10.6个月。且研究数据表明,无论食管癌患者PD-L1表达状态如何,生存期均显著延长:PD-L1评分≥10%的患者中位生存期为16.6个月(对照组为10个月);PD-L1评分<10%的患者中位生存期为16.7个月(对照组为10.4个月)。
对于备受癌症困扰的患者,寻找权威的医院及医生诊治,了解全球先进的治疗药物,或许可以找到更有效的、延长生存期的治疗方案。厚朴方舟作为海外医疗服务机构中的佼佼者,与美国、日本、英国100多家世界知名的癌症治疗中心有着深入的合作关系,已经为许许多多的癌症患者提供服务,帮助患者延长生存期。如希望了解更多癌症治疗前沿资讯,或想预约癌症权威医院及专家诊治的朋友,可以直接在线咨询医学顾问或拨打热线400-086-8008联系我们。
参考来源:
[1] Bristol Myers Squibb - U.S. Food and Drug Administration Approves Two Opdivo® (nivolumab)-Based Regimens as First-Line Treatments for Unresectable Advanced or Metastatic Esophageal Squamous Cell Carcinoma
[2]Solasia Pharma: DARVIAS® Injection 135mg (Generic Name: DARINAPARSIN /Development Code: SP-02) Approved in Japan | Business Wire
[3] Ogura et al., (2021). Phase I studies of darinaparsin in patients with relapsed or refractory peripheral T-cell lymphoma: a pooled analysis of two phase I studies conducted in Japan and Korea, Jpn J Clin Oncol, DOI: 10.1093/jjco/hyaa177
[4]Servier Announces FDA Approval of TIBSOVO® (ivosidenib tablets) in Combination with Azacitidine for Patients with Newly Diagnosed IDH1-mutated Acute Myeloid Leukemia
[5]Novartis Tafinlar + Mekinist receives FDA approval for
[6]ImmunoGen Announces Acceptance of Biologics License Application for Mirvetuximab Soravtansine in Ovarian Cancer by US Food and Drug Administration with Priority Review | Business Wire
[7]New Phase III data show Novartis tislelizumab significantly
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:2022年抗癌药物盘点 | 治疗肺癌乳腺癌效果好的新药有哪些 下一篇:2022年8月国际癌症治疗进展,治疗乳腺癌、肺癌、前列腺癌等多款新药获批
热门服务
推荐阅读
日本权威医学专家
日本医院排名
服务案例更多>
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号