 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

首页 > 医疗前沿资讯 > 海外前沿药物 > 罕见病:视神经脊髓炎新上市药物盘点
罕见病:视神经脊髓炎新上市药物盘点
【本文为疾病百科知识,仅供阅读】 2020-09-09 作者:厚朴方舟
视神经脊髓炎(neuromyelitis optica,NMO)是一种视神经与脊髓同时或相继受累的急性或亚急性脱髓鞘病变,在2018年5月11日国家卫生健康委员会等5部门联合制定的《罕见病目录》,视神经脊髓炎就位列其中。这种罕见的疾病有复发、缓解、再复发的特点,预防和治疗都极其困难,且目前临床上尚未有能够病愈视神经脊髓炎的方法,因此无论是患者还是医生,对新型的治疗药物都十分关注。

视神经脊髓炎
视神经脊髓炎(NMO)即视神经脊髓炎谱系障碍(NMOSD) ,2015年6月国际视神经脊髓炎诊断小组对视神经脊髓炎命名和诊断标准作了修订,取消了视神经脊髓炎医学术语,统一命名为视神经脊髓炎谱系疾病。但是由于目前多数人对于视神经脊髓炎更为熟悉,因此本文中也采用视神经脊髓炎指代视神经脊髓炎谱系障碍。
视神经脊髓炎是一种罕见的中枢神经系统自身免疫性疾病,患者的免疫系统侵袭视神经和脊髓,导致视力丧失和瘫痪。视神经脊髓炎的一般特征是病程不可预测和具有复发性,每次发作都会导致伤残情况越来越严重。虽然大多数患者在疾病发作后能恢复部分功能,但也有部分患者会出现视力丧失以及(或者)多种神经症状;有一些患者甚至导致死亡。
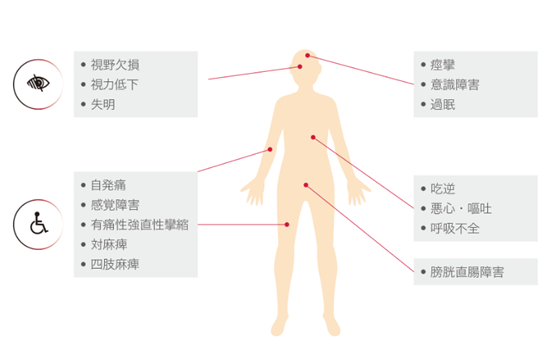
▲NMOSD的主要症状(图源:soliris.jp)
视神经脊髓炎同时含有视神经和脊髓症状,病发时,患者可能出现视神经炎,即视神经的炎症,导致眼睛疼痛,单眼或双眼视力下降,以及(或者)出现横贯性脊髓炎,即一部分脊髓发炎,引起感觉变化、以及可能导致膀胱和肠道失控、出现麻痹、刺痛和可能性瘫痪。
视神经脊髓炎治疗药物
视神经脊髓炎不会自行消退,所以患者终身需要预防性治疗,尽管有许多药物可以成功抑制视神经脊髓炎患者的免疫系统,但在2019 年6 月,FDA 才初次批准了一种药物——Soliris(eculizumab)用于治疗视神经脊髓炎。今年,FDA又批准了两种药物Uplizna和Enspryng用于视神经脊髓炎。
1.Soliris
2019年6月,补体抑制剂Soliris(eculizumab)获得美国FDA批准,用于抗AQP4抗体阳性视神经脊髓炎成人患者。2019年8月底,Soliris再获欧盟批准,用于AQP4抗体阳性且伴有复发病程的视神经脊髓炎成人患者。在美国和欧盟,Soliris是率先被批准治疗视神经脊髓炎的药物。目前该药物虽然还未在国内上市,但已经在日本成功上市可用于治疗视神经脊髓炎。
▲图源:alexion
2.Uplizna
2020年6月,抗CD19单抗药物Uplizna(inebilizumab-cdon,前称MEDI-551)获得美国FDA批准,在初始剂量后作为一年2次的维持方案,用于治疗抗AQP4抗体阳性的视神经脊髓炎成人患者。值得一提的是,Uplizna是初个也是仅有的一个被批准用于治疗AQP4抗体阳性视神经脊髓炎成人患者的B细胞消耗剂。

▲图源:globenewswire
Uplizna的活性药物成分inebilizumab是一种人源化CD19导向性单克隆抗体,与CD19具有很高的亲和力,CD19是一种广泛表达于B细胞的蛋白质,包括分泌抗体的浆母细胞和一些浆细胞。inebilizumab与CD19结合后,这些细胞迅速从循环系统中耗竭。
3.Enspryng
2020年08月14日,美国食品和药物管理局(FDA)已批准Enspryng(satralizumab),用于治疗抗水通道蛋白-4(AQP4)抗体阳性的视神经脊髓炎成人患者。视神经脊髓炎是一种罕见的、终生的、使人衰弱的中枢神经系统自身免疫性疾病,常被误诊为多发性硬化症(MM)。视神经脊髓炎主要损害视神经和脊髓,导致失明、肌无力和瘫痪。
▲图源:prnewswire
值得一提的是,Enspryng是初个也是仅有的一个获FDA批准治疗AQP4抗体阳性视神经脊髓炎的皮下治疗方案,可由患者自己或护理人员,每4周皮下注射一次。同时,Enspryng是率先获批也是仅有的一个靶向抑制白细胞介素-6受体(IL-6R)活性治疗视神经脊髓炎的治疗方案。在2项关键III期研究中,Enspryng作为一种单一治疗方法和作为基线免疫抑制剂治疗(IST)的附加治疗方法,在广泛的视神经脊髓炎患者群体中显示了强大的疗效,并显著降低了复发的风险。截至目前,Enspryng也在日本、加拿大、瑞士获得了批准。
目前虽然治疗视神经脊髓炎的药物并不多,但是研究人员从未停止过对视神经脊髓炎治疗药物的研究,旨在为视神经脊髓炎患者寻找治疗的新方向,尽可能得改善视神经脊髓炎的生活质量,让每一位患者获得更好地治疗。如果希望了解更多有关视神经脊髓炎药物的其他信息可以拨打热线电话400-086-8008了解。
参考来源:
【1】日本神经科学学会监督,《多发性硬化症和视神经脊髓炎指南》,2017年,由医学研究所编写
【2】CISION:FDA Approves Treatment for Rare Disease Affecting Optic Nerves, Spinal Cord
https://www.prnewswire.com/news-releases/fda-approves-treatment-for-rare-disease-affecting-optic-nerves-spinal-cord-301113352.html
【3】麻省总医院:视神经脊髓炎谱系障碍(NMOSD) 简介
https://www.massgeneral.org/neurology/treatments-and-services/about-nmo-cn
【4】GlobeNewswire:Viela Bio Announces U.S. FDA Approval of UPLIZNA™ (inebilizumab-cdon) for the Treatment of Neuromyelitis Optica Spectrum Disorder (NMOSD)
https://www.globenewswire.com/news-release/2020/06/11/2047190/0/en/Viela-Bio-Announces-U-S-FDA-Approval-of-UPLIZNA-inebilizumab-cdon-for-the-Treatment-of-Neuromyelitis-Optica-Spectrum-Disorder-NMOSD.html
【5】Alexion:Alexion Receives FDA Approval of SOLIRIS® (eculizumab) for the Treatment of Adults with Neuromyelitis Optica Spectrum Disorder (NMOSD) who are Anti-Aquaporin-4 (AQP4) Antibody Positive
https://ir.alexion.com/news-releases/news-release-details/alexion-receives-fda-approval-solirisr-eculizumab-treatment
【6】Soliris:关于NMOSD
https://soliris.jp/physicians/disease/nmosd
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
热门服务
推荐阅读
日本权威医学专家
日本医院排名
服务案例更多>
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号