 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

胆管癌靶向治疗时代来临,无进展、总生存期双延长
【本文为疾病百科知识,仅供阅读】 2021-04-25 作者:厚朴方舟
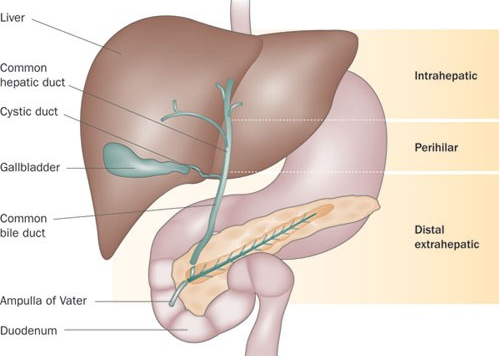
胆管癌全球发病率和死亡率近年均呈上升态势 [1]。由于胆管癌患者早期症状不明显,疾病确诊时多为中晚期,可经手术治疗的患者仅为35%左右,且术后易复发,5年生存率约为5%~15%[3]。且现有的化疗方案效果不佳,中位生存期小于1年[4],预后不理想。迫切需要新的诊治方案。随着近年来生物检测技术的成熟,胆管癌潜在的分子病理正在逐步被揭示,靶向治疗的研究也越来越多。2020 年 4 月,成纤维细胞生长因子受体(FGFR)抑制剂Pemazyre(培米替尼)获美国 FDA 批准上市,成为全球头款胆管癌靶向药物。今年,胆管癌靶向治疗药物纷纷崭露头角,显现出在胆管癌临床治疗中的显著效果。
▲图源:nature
1.全球初款胆管癌靶向药物
2020年4月,Pemazyre率先获得美国FDA批准,用于局部晚期或转移性胆管癌的治疗。2021年3月23日,日本厚生劳动省(MHLW)批准选择性成纤维细胞生长因子受体(FGFR)激酶抑制剂Pemazyre(pemigatinib),用于治疗在接受抗癌化疗后病情恶化、携带FGFR2融合基因的不可切除性胆管癌(BTC)患者。
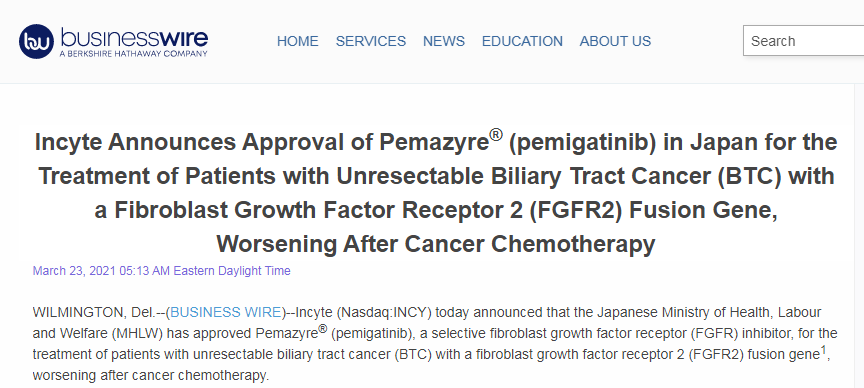
▲图源:businesswire
此次获批是基于FIGHT-202研究的结果,临床数据显示,在携带FGFR2融合或重排的患者中,中位随访15个月,Pemazyre单药治疗的总缓解率(ORR)为36%,中位缓解持续时间(DoR)为7.49个月[5]。
注:根据解剖位置的不同,胆管癌常见的分类为:肝内胆管癌(iCCA)、肝门部胆管癌(pCCA)和远端胆管癌(dCCA),后两者也被合并称为肝外胆管癌(eCCA)。胆管癌与胆囊癌(GBC)合并称为胆道癌(BTC)。
2.Futibatinib治疗胆管无进展、总生存期双延长
4月12日,美国癌症研究协会(AACR)2021年会公布了共价结合FGFR抑制剂futibatinib(TAS-120)2期FOENIX-CCA2研究的效果和安全性数据。此次研究是一项单臂多中心研究,正在评估futibatinib治疗携带FGFR2基因重排(包括基因融合)、接受过至少一种方法治疗失败的局部晚期或转移性肝内胆管癌(iCCA)患者。

▲图源:prnewswire
研究结果显示,futibatinib治疗的客观缓解率(ORR)为41.7%;中位缓解持续时间(DOR)为9.7个月,72%的患者缓解时间超过6个月,疾病控制率(DCR)为82.5%;中位无进展生存期(PFS)为9.0个月、中位总生存期(OS)为21.7个月,72%的患者在12个月时存活[6]。
今年2月,基于FOENIX-CCA2研究的数据,美国FDA授予了futibatinib突破性药物资格(BTD),用于治疗携带FGFR2基因重排(包括基因融合)、先前接受过治疗的局部晚期或转移性胆管癌(CCA)患者。
3.未来展望
除了Futibatinib之外,IDH1抑制剂Tibsovo也正处于临床试验中,今年1月在美国临床肿瘤学会胃肠道癌研讨会中,公布了Tibsovo治疗胆管癌的效果,临床数据显示,Tibsovo相比对照组,提高了患者的总生存期(OS:10.3个月vs7.5个月)[7]。

▲图源:globenewswire
越来越多的证据表明,针对胆管癌,临床涌现了更多的小分子靶向治疗的相关研究,且靶向药物在胆管癌治疗领域显现出良好的效果,虽然目前仅获批了一个胆管癌靶向治疗药物:Pemazyre。但是相信随着研究人员的不断探索,不久的将来,会有更多的靶向药物获批用于胆管癌患者,大幅提高患者的生存获益。如希望了解更多有关胆管癌治疗方案,可拨打热线400-086-8008联系我们。
参考来源:
[1]Banales J M, Marin J J G, Lamarca A, et al. Cholangiocarcinoma 2020: the next horizon in mechanisms and management[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(9): 557-588.
[2] Informa PLC. Datamonitor Healthcare[DB/OL]. [2020-09-11].
https://service.datamonitorhealthcare.com/hkc/login/.
[3]Krasinskas A M. Cholangiocarcinoma[J]. Surg Pathol Clin, 2018,11(2): 403-429.
[4] Rizvi S, Khan S A, Hallemeier C L, et al. Cholangiocarcinomaevolving concepts and therapeutic strategies[J]. Nat Rev Clin Oncol , 2018, 15(2): 95-111
[5]Incyte Announces approval of Pemazyre® (pemigatinib) in Japan for the Treatment of Patients with Unresectable Biliary Tract Cancer (BTC) with a Fibroblast Growth Factor Receptor 2 (FGFR2) Fusion Gene, Worsening After Cancer Chemotherapy
[6]Taiho Oncology Announces Presentation of Phase 2 Data for Futibatinib (TAS-120) in Advanced Intrahepatic Cholangiocarcinoma at Virtual AACR Annual Meeting 2021
[7]Agios Presents Final Data from Phase 3 ClarIDHy Study of TIBSOVO in Patients with Previously Treated IDH1-Mutant Cholangiocarcinoma
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:多个晚期胃癌靶向治疗药物获批,胃癌治疗开启精准医疗时代 下一篇:恶性胸膜间皮瘤15年来突破!Opdivo+Yervoy显著提高生存
热门服务
推荐阅读
日本权威医学专家
日本医院排名
服务案例更多>
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号